Termodinamica
Termodinamica se ocupă cu studiul macroscopic al fenomenelor, de orice natură, în care are loc un transfer de energie sub forma de căldură și lucru mecanic. Numele este derivat din limba greacă (θέρμη therme = căldură, δύναμις dynamis = forță) și a fost creat de lordul Kelvin care a formulat și prima definiție a termodinamicii. În germană termodinamica mai poartă și numele de Wärmelehre (teoria căldurii) creat de Rudolf Clausius in lucrările sale despre teoria mecanică a căldurii.Termodinamica reprezintă în zilele noastre una din cele mai bine structurate logic ramuri ale fizicii. Născută la începutul secolului al XIX-lea din necesitatea practică de a optimiza randamentul motoarelor cu abur, termodinamica a devenit una din disciplinele clasice ale fizicii teoretice. Baza teoretică a termodinamicii o constituie un număr restrâns de principii, care sunt generalizări și abstractizări ale unor fapte experimentale. Caracterul general al acestor principii, care nu conțin ipoteze referitor la natura forțelor implicate sau la structura microscopică a sistemelor studiate, face ca metodele termodinamicii să fie aplicabile unei clase largi de fenomene. Operele lui Josiah Willard Gibbs au extins domeniul de preocupare al termodinamicii de la orientarea spre randamentul mașinilor termice către studiul caracteristicilor substanțelor și sistemelor. Câteva exemple, alese oarecum la întâmplare: proprietățile fluidelor și ale soluțiilor, echilibrul stărilor de agregare, polarizarea dielectrică și magnetizarea, radiația termică. Aplicațiile practice sunt și ele numeroase și variate, de la frigider și încălzire centrală la energie regenerabilă și prognoză meteorologică.
O abordare alternativă a fenomenelor termodinamice o reprezintă mecanica statistică. Pornind de la structura microscopică (molecule și atomi), luând în considerare interacțiunile (forțele) dintre aceste componente și folosind metode statistice (aplicabile sistemelor alcătuite dintr-un număr foarte mare de componente), mecanica statistică poate, prin intermediul unor calcule laborioase, să deducă (și prin aceasta să confirme) rezultatele obținute de termodinamică pe cale fenomenologică.
Există diverse incercări de axiomatizare a acestei discipline. Prima dintre ele a fost cea a lui Constantin Carathéodory publicată in 1909 intr-un periodic de matematică. Axiomatizarea lui Carathéodory a fost relativ ignorată de fizicieni datorită publicării intr-un periodic de matematică și nu a fost bine primită de Max Planck.
După accentul pus pe anumite domenii aplicative din termodinamica generală sau fundamentală se individualizează ramurile termodinamica sistemelor fizice, termodinamica sistemelor chimice și termodinamica tehnică.
Dilatare corpurilor:
Dilatarea termică este fenomenul fizic prin care dimensiunile (volumul, suprafața, lungimea) unui corp cresc în urma variației temperaturii. Fenomenul opus se numește contracție termică. Pentru majoritatea substanțelor creșterea temperaturii duce la creșterea dimensiunilor, dar există și excepții.
În funcție de starea de agregare a corpului, dilatarea se manifestă diferit. Astfel, un corp solid își mărește toate dimensiunile liniare în același raport, un lichid își mărește volumul (forma sa depinde de vasul care îl conține), iar un gaz își mărește fie presiunea, fie volumul, fie amîndouă, în funcție de incinta în care se află. Modificarea valorii volumului produce modificarea valoriidensității și în cazul amestecurilor a valorilor concentrațiilor raportate la volum ale componenților: concentrația molară și masică.
Coeficent de dilatare:
Pentru solide creșterea relativă a unei dimensiuni (raportul dintre variația dimensiunii și dimensiunea inițială) este proporțională cu creșterea temperaturii. Coeficientul de proporționalitate se numește coeficient de dilatare termică, o mărime de obicei pozitivă, a cărei unitate de măsură este inversul unității de măsură a temperaturii. Pentru polimeri (de exemplu materiale plastice) acest coeficient este de circa 10 ori mai mare decît pentru metale, care la rîndul lor au un coeficient mai mare decît al ceramicilor.

Se măsoară cu dilatometrul.
Dilatarea amestecurilor depinde de neidealitatea acestora prin intermediul mărimilor de exces.

unde Vi sunt volumele componenților puri iar ViE sunt sunt volumele exces ale componenților.
Prin derivare cu temperatura rezultă

sau considerând volumul exces funcție de coeficientul de activitate al unui component in amestec și substituind



Prin introducerea coeficientului de dilatare


Legea lui Dalton:
Aerul utilizat în scufundare este aerul atmosferic comprimat în buteliile aparatului de respirat sub apă, cu ajutorul compresorului. Aerul atmosferic este un amestec natural de gaze.
Compoziția aerului exprimată prin procent volumic al componentelor este următoarea:
- Oxigen (O2): 20,93 %
- Azot (N2): 78,10 %
- Argon (Ar): 0,9325 %
- Bioxid de carbon (CO2): 0,01 %
- Hidrogen (H2): 0,0018 %
- Neon (Ne): 0,0005 %
- Kripton (Kr): 0,0001 %
- Xenon (Xe): 0,00000 %
Relatia lui Robert Mayer:
Căldura molară/ specifică a unui material este cantitatea de căldură necesară pentru a ridica cu un grad Celsius/Kelvin temperatura unui mol/gram din acel material. Între căldura molară măsurată la presiune constantă Cp și cea măsurată la volum constant Cv este o diferență deoarece o parte din căldura transmisă la presiune constantă (deci atunci când volumul își poate schimba valoarea) este folosită pentru a efectua lucru mecanic asupra exteriorului ca urmare a dilatării materialului.Dacă materialul este un mol de gaz perfect, și deci are loc relația[1]:
Deci, pentru un gaz perfect are loc relația lui Mayer:
Principiul întâi al termodinamicii:
Principiul întâi al termodinamicii constituie o particularizare a legii conservării energiei la procesele în care intervine mișcarea termică a materiei, adică mișcarea dezordonată a unui număr mare de particule (atomi, molecule etc.).Transfer de energie:Energia unui sistem termodinamic este egală cu suma tuturor energiilor particulelor componente. Energia unui sistem se măsoară în raport cu un sistem de referință solidar cu sistemul termodinamic și cu originea în centrul de inerție al sistemului.
Ca urmare a interacțiunii dintre sistemul fizic și mediul exterior poate avea loc un transfer de energie. Acest transfer de energie se poate face cu sau fără variația parametrilor externi. În cazul în care interacțiunea are loc cu variația parametrilor externi, avem de-a face cu un proces mecanic sau cu o acțiune mecanică iar energia transferată se numește lucru mecanic. Un proces de interacțiune are loc și în alte situații când parametrii externi care variază sunt inducția electrică, inducția magnetică etc. Daca interacțiunea are loc fără variația parametrilor externi, transmiterea energiei se numește schimb de căldură, iar energia transmisă se numește căldură. Rezultă că deși lucrul mecanic și căldura au dimensiunile unei energii, ele nu sunt forme de energie, ci forme de schimb de energie și nu sunt echivalente. Lucrul mecanic este o forma macrofizică (ordonată) de transmitere a energiei de la un sistem la altul, în timp ce căldura este o forma microfizică (neordonată) de transmitere a energiei.
Aplicații ale principiului întâi al termodinamicii la gazele perfecte. Capacități termice ale gazelor.Se numește capacitate termică C a unui sistem într-un anumit proces considerat și la o anumită temperatură căldura necesară pentru a ridica cu un grad temperatura sistemului, fără schimbarea stării de agregare.

Unitatea de măsură a lui C în Sistemul Internațional de unități este J/K.
Capacitatea termică raportată la unitatea de masă dintr-o substanță omogenă se numește capacitate termică masică, iar cea raportată la unitatea de volum capacitate termică volumică. Vechea denumire de căldură specifică este ambiguă și nerecomandată.
 J/(kg K)respectiv
J/(kg K)respectiv
 J/(m3 K).Capacitatea termică kilomolară, folosită mai ales la gaze, reprezintă capacitatea termică a unui kilomol de gaz și se măsoară în J/(kmol K).
J/(m3 K).Capacitatea termică kilomolară, folosită mai ales la gaze, reprezintă capacitatea termică a unui kilomol de gaz și se măsoară în J/(kmol K).
Deoarece cantitatea de căldură nu este o funcție de stare, valoarea capacității termice va depinde felul transformărilor prin care trece sistemul.
În fizică cele mai folosite sunt căldurile molare la volum constant (Cv) și la presiune constantă (Cp) care se definesc prin cantitatea de căldură necesară încălzirii cu un grad a unui mol de gaz când se menține constant volumul, respectiv presiunea.
Energia internă a unui gaz este, în general, o funcție atât de T cât și de V și prin urmare:

Dacă se consideră o transformare la volum constant (  ),
),  rezultă:
rezultă:

Conform definiției, capacitatea termică molară la volum constant va fi:

În mod analog capacitatea termică molară la presiune constantă este dată de relația:
![C_p = \left ( \frac{\delta\ Q}{dT} \right )_p = \left ( \frac{\partial U}{\partial T} \right )_V + \left [ \left ( \frac{\partial U}{\partial V} \right )_T + p \right ] \left ( \frac{\partial V}{\partial T} \right )_p](https://lh3.googleusercontent.com/blogger_img_proxy/AEn0k_uBLmnRPuJUaGzUNAq5iAVkXEnyEO7qf244-l3UZgo-iS1HRKkXD2svCCu14MwcYxEx5s4q3TPgocbj9LtXVFyoTtMNPUQ0pZDiiXG5RHUf5i99tpQgu2eogp41YjuQ9XYAGdStjjLZt0t8R48ZRA=s0-d)
Din relațiile de mai sus rezultă legătura dintre căldurile la volum și respectiv presiune constantă:
![C_p - C_v = \left [ \left ( \frac{\partial U}{\partial V} \right )_T + p \right ] \left ( \frac{\partial V}{\partial T} \right )_p](https://lh3.googleusercontent.com/blogger_img_proxy/AEn0k_v2BwHLldHK1iIMRyUKds7NIasFFAUkx3hKF3FiqKmH543fwhwFPp05nNxs6yLlfXD_o4LBamUlxCyIXFCQUSYqIM2QOW_K_dulBpp2ryEc9bEjyG4J4doTnEgkmWlRBNfK1_NUoGCgNtrazZPENg=s0-d)
Pentru un gaz perfect energia internă depinde numai de temperatură  ; aceasta se explică prin aceea că volumul ocupat de moleculele și interacțiunile dintre ele pot fi neglijate. Ca urmare, ținând cont și de ecuația de stare pV = RT (scrisă pentru un mol de gaz) se obține:
; aceasta se explică prin aceea că volumul ocupat de moleculele și interacțiunile dintre ele pot fi neglijate. Ca urmare, ținând cont și de ecuația de stare pV = RT (scrisă pentru un mol de gaz) se obține:

relație cunoscuta sub denumirea de relația lui R. Mayer.
Daca se ține cont de expresia energiei interne a unui mol de gaz perfect  , unde i este numărul gradelor de libertate, atunci:
, unde i este numărul gradelor de libertate, atunci:


Un rol important în descrierea comportării gazelor îl joacă raportul dintre căldura molară la presiune constantă și căldura molară la volum constant:

Acest raport este denumit exponent adiabatic și pentru gaze perfecte are urmatoarele valori:
- gaze monoatomice:
 (He, Ne, Ar, Kr ...)
(He, Ne, Ar, Kr ...)
- gaze biatomice:
 (N2, O2 ...)
(N2, O2 ...)
- gaze tri sau poliatomice:
 (H2O, NH3, CH4 ...)
(H2O, NH3, CH4 ...)
Principiul al doilea al termodinamicii:
Principiul al doilea al termodinamicii precizează condițiile în care are loc transformarea energiei termice în energie mecanică. El are un caracter calitativ, arată sensul în care se produc spontan transformările, fără să se refere la cantitățile de energie schimbate. El este o particularizare a principiului general al schimburilor de energie, conform căruia transformările spontane de energie se realizează de la potențialul mai înalt spre potențialul mai scăzut.
Procese reversibile și ireversibile:
Dacă principiul întâi al termodinamicii a fost un precursor al legii conservării energiei în domeniu proceselor termice, cel de al doilea principiu al termodinamicii a fost formulat ca o lege specifică proceselor termice. Cel de-al doilea principiu al termodinamicii reprezintă o generalizare a rezultatelor experimentale legate de funcționarea mașinilor termice.Principiul întâi al termodinamicii pune în evidență echivalența cantitativă dintre căldură și lucru mecanic, însă el nu face nicio referire la direcția de desfășurare a proceselor termodinamice.Se spune că un proces de trecere dintr-o stare inițială 1 într-o stare finală 2 este reversibil, dacă este posibilă revenirea în starea inițială 1 astfel încât la această stare a sistemului considerat și starea sistemelor înconjurătoare să fie identică cu starea lor inițială. Dacă la revenirea sistemului considerat în starea inițială 1, starea sistemelor înconjurătoare diferă de starea lor inițială, atunci procesul este ireversibil.
Ciclul Carnot:
Articol principal: Ciclul Carnot.Descoperirea principiului al doilea al termodinamicii a fost legată de îmbunătățirea mașinilor termice.Ciclul Carnot a fost propus de inginerul francez Sadi Carnot în scopul îmbunătățirii randamentului motoarelor termice. Este un ciclu teoretic, alcătuit din două transformări adiabatice și doua transformări izoterme. Motorul imaginat de Carnot folosea drept agent termic gaz perfect ce suferea transformări cvasistatice.

Temperatura termodinamică:
Studiul ciclului Carnot permite, printre altele, definirea temperaturii termodinamice absolute. Dacă parcurgerea ciclului este reversibilă, din expresia randamentului ciclului Carnot reiese ca raportul Qcedat / Qprimit rămâne constant și independent de natura substanței de lucru, dacă mașina lucrează între aceleași temperaturi T și T0.
Formularea principiului al doilea al termodinamicii:
Formularea lui Carnot:
Studiind randamentul mașinilor termice ce funcționează după un ciclu format din două izoterme și două adiabate, Sadi Carnot a formulat următoarele teoreme:
- Teorema I. Randamentul unei mașini termice reversibile depinde numai de temperatura sursei calde și a sursei reci și nu depinde de natura substanței de lucru.
- Teorema II. Randamentul unei mașini termice ireversibile este întotdeauna mai mic decât randamentul unei mașini termice care funcționează reversibil între aceleași limite de temperatură.
Daca ambele mașini, atât cea reversibilă cât și cea ireversibilă primesc de la sursa caldă aceeași cantitate de caldura Q și cedează sursei reci cantitatea de căldură Q0, respectiv Q0', rezultă că randamentul mașinii reversibile va fi:

iar al mașinii ireversibile este:

Cele două teoreme ale lui Carnot pot fi scrise sub forma

Semnul egal se referă la ciclul reversibil iar semnul < la cel ireversibil.
Studiind randamentul mașinilor termice ce funcționează după un ciclu format din două izoterme și două adiabate, Sadi Carnot a formulat următoarele teoreme:
- Teorema I. Randamentul unei mașini termice reversibile depinde numai de temperatura sursei calde și a sursei reci și nu depinde de natura substanței de lucru.
- Teorema II. Randamentul unei mașini termice ireversibile este întotdeauna mai mic decât randamentul unei mașini termice care funcționează reversibil între aceleași limite de temperatură.
Daca ambele mașini, atât cea reversibilă cât și cea ireversibilă primesc de la sursa caldă aceeași cantitate de caldura Q și cedează sursei reci cantitatea de căldură Q0, respectiv Q0', rezultă că randamentul mașinii reversibile va fi:

iar al mașinii ireversibile este:

Cele două teoreme ale lui Carnot pot fi scrise sub forma

Semnul egal se referă la ciclul reversibil iar semnul < la cel ireversibil.
Formularea lui W. Thomson (lord Kelvin):
Este imposibilă construirea unui perpetuum mobile de speța a doua (adică a unei mașini termice care ar transforma periodic, fără compensație căldura unui corp oarecare în lucru mecanic). Cu alte cuvinte este imposibil ca o mașină termică să funcționeze numai cu o singură sursă termică. Din principiul al doilea al termodinamicii rezultă că dacă lucrul mecanic se poate transforma integral în căldură, inversul nu este posibil. Din această cauză fenomenele naturale sunt ireversibile și decurg într-un singur sens. De această formulare este legat cunoscutul paradox aldemonului lui Maxwell.
Este imposibilă construirea unui perpetuum mobile de speța a doua (adică a unei mașini termice care ar transforma periodic, fără compensație căldura unui corp oarecare în lucru mecanic). Cu alte cuvinte este imposibil ca o mașină termică să funcționeze numai cu o singură sursă termică. Din principiul al doilea al termodinamicii rezultă că dacă lucrul mecanic se poate transforma integral în căldură, inversul nu este posibil. Din această cauză fenomenele naturale sunt ireversibile și decurg într-un singur sens. De această formulare este legat cunoscutul paradox aldemonului lui Maxwell.
Formularea lui Ostwald:
Formularea lui Clausius:
Într-un proces arbitrar, căldura trece de la sine doar de la corpurile cu temperatură mai mare la corpurile cu temperatură mai mică. Cu alte cuvinte, fără cheltuială de lucru mecanic este imposibil să se treacă căldură de la un corp mai rece la un corp mai cald.
Într-un proces arbitrar, căldura trece de la sine doar de la corpurile cu temperatură mai mare la corpurile cu temperatură mai mică. Cu alte cuvinte, fără cheltuială de lucru mecanic este imposibil să se treacă căldură de la un corp mai rece la un corp mai cald.
Formularea lui Planck:
Formularea lui Caratheodory:
În orice vecinătate a unei stări arbitrare a unui sistem termodinamic în stare de echilibru există stări care nu pot fi atinse prin procese adiabatice. Formularea lui Caratheodory sugerează existenta unei funcții de stare a cărei valoare este constantă pentru transformările adiabatice reversibile. Această funcție de stare se numește entropie empirică și este notată cu s. Entropia empirică se modifică în toate procesele care au loc cu schimb de caldură. Căldura infinitezimală schimbată de sistem poate fi scrisă sub forma:

În orice vecinătate a unei stări arbitrare a unui sistem termodinamic în stare de echilibru există stări care nu pot fi atinse prin procese adiabatice. Formularea lui Caratheodory sugerează existenta unei funcții de stare a cărei valoare este constantă pentru transformările adiabatice reversibile. Această funcție de stare se numește entropie empirică și este notată cu s. Entropia empirică se modifică în toate procesele care au loc cu schimb de caldură. Căldura infinitezimală schimbată de sistem poate fi scrisă sub forma:
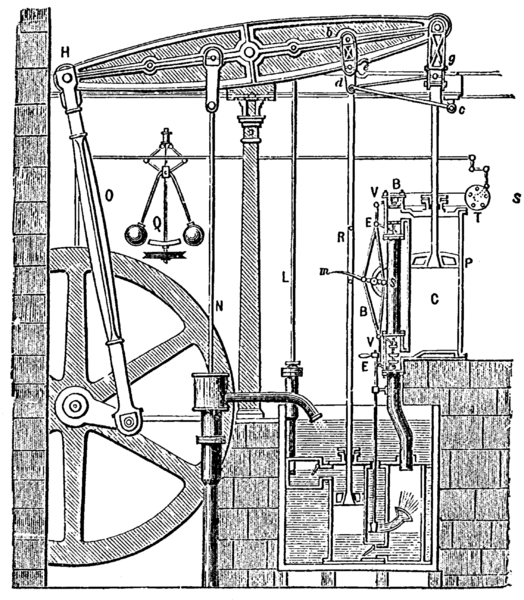
Motorul Otto:
Figura din stânga prezintă principalele părţi componente ale unui motor cu adere internă, în 4 timpi, cu aprindere prin scânteie electrică. În continuare le voi descrie pentru a se înţelege despre ce e vorba.Supape- Au rolul de a deschide şi închide orificiile prin care se realizează admisia combustibilului în cilindru şi evacuare gazelor arse. Supele execută o mişcare de translaţie, fiind comandate de camele de pe axul cu came (ca în animaţia alăturată, unde axul cu came are culoarea verde)
La sfârşitul compresiei, când pistonul a ajuns la punctul mort superior şi ambele supape sunt închise, se produce o scânteie electrică între electrozii bujiei. Scânteia aprinde amestecul carburant care începe să ardă progresiv. Temperatura rezultată este de circa 2000°C şi presiunea de aproximativ 25 atm. Gazele produc o forţă mare de apăsare asupra pistonului împingâdu-l spre punctul mort inferior. Pe măsură ce pistonul coboară, gazele se destind - are loc detenta. Acum este singurul moment când se produce lucru mecanic.
Supapa de admisie este închisă, iar cea de evacuare este deschisă, permiţând gazelor arse din cilindru să fie împinse afară din cilindru de pistonul care se deplasează de la punctul mort inferior spre punctul mort superior.Graficul alăturat, prezintă schema de funcţionare a motorului Otto, în coordonatele presiune (P) şi volum (V). Motorul Diesel:
| (1) |
Nikolaus August Otto s-a născut în anul 1832 în localitatea Holzhasen din Germania. A absolvit cursurile politehnice, obţinând diploma de inginer. În 1867, împreună cu inginerul Eugen Langen (1833-1895), Otto a construit un motor termic cu ardere internă, cu piston în patru timpi, care folosea combustibil gazos.
Cilindrul- Reprezintă componenta în care culisează pistonul. Motorul descris aici are un singur cilindru, dar majoritatea motoarelor au mai mulţi cilindrii (4, 6 sau 8). Motoarele, dacă au mai mulţi cilindrii, pot fi: în linie, în V sau opuşi orizontal (boxer), ca în figură:
 În funcţie de configuraţie, diferă nivelul vibraţii şi zgomot, costul de fabricare şi caracteristicile ce le fac mai potrivite sau nu pentru anumite tipuri de autovehicule.Pistonul- Este o piesă din mecanismul bielă-manivelă, confecţionat din aliaj de aluminiu, turnat, având formă cilindrică, care culisează în cilindru.
În funcţie de configuraţie, diferă nivelul vibraţii şi zgomot, costul de fabricare şi caracteristicile ce le fac mai potrivite sau nu pentru anumite tipuri de autovehicule.Pistonul- Este o piesă din mecanismul bielă-manivelă, confecţionat din aliaj de aluminiu, turnat, având formă cilindrică, care culisează în cilindru.
Camera de ardere- Reprezintă locul unde are loc compresia şi arderea amestecului de aer cu combustibil. Camera de ardere îşi schimbă volumul odată cu mişcarea pistonului. Capacitatea camerei de ardere oferă de obicei o idee asupra puterii motorului.
Timpul 1- Absorbţia
Timpul 4- Evacuarea
Ciclul de funcţionare al motorului Otto
Niciun comentariu:
Trimiteți un comentariu